
科技改變生活 · 科技引領(lǐng)未來

科技改變生活 · 科技引領(lǐng)未來
據(jù)米內(nèi)網(wǎng)數(shù)據(jù)顯示,截至2019年9月12日,通過或視同通過一致性評價的產(chǎn)品有149個,獲批的批文數(shù)量達378個。在欣喜一致性評價工作取得穩(wěn)步前進的同時,也有少數(shù)產(chǎn)品未能過評,其中不乏多個10億大品種,這些產(chǎn)品為何通過不了呢?32個產(chǎn)品未獲批
據(jù)米內(nèi)網(wǎng)數(shù)據(jù)顯示,截至2019年9月12日,通過或視同通過一致性評價的產(chǎn)品有149個,獲批的批文數(shù)量達378個。在欣喜一致性評價工作取得穩(wěn)步前進的同時,也有少數(shù)產(chǎn)品未能過評,其中不乏多個10億大品種,這些產(chǎn)品為何通過不了呢?
32個產(chǎn)品未獲批通過一致性評價,注射劑占41%
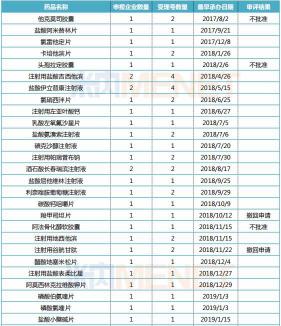
米內(nèi)網(wǎng)MED中國藥品審評數(shù)據(jù)庫2.0數(shù)據(jù)顯示,截至目前,申報一致性評價的產(chǎn)品有401個,其中完成審評審批程序“已發(fā)件”的產(chǎn)品約有137個,這些產(chǎn)品中有34個未能獲批,其中,石家莊龍澤制藥的拉米夫定片、四川匯宇制藥的多西他賽注射液按新分類獲批收錄進了上市藥品目錄集,視同通過一致性評價,其余32個產(chǎn)品目前暫無企業(yè)過評。
這32個未能通過一致性評價的產(chǎn)品,從劑型來看,口服劑型片劑、膠囊劑共有19個,合計占比達59%,注射劑有13個,占比約為41%。
8個10億大品種首家過評要等多久?國內(nèi)巨頭正在發(fā)力
據(jù)米內(nèi)網(wǎng)數(shù)據(jù)顯示,上述32個產(chǎn)品2018年在中國城市公立醫(yī)院、縣級公立醫(yī)院、城市社區(qū)中心及鄉(xiāng)鎮(zhèn)衛(wèi)生院(簡稱中國公立醫(yī)療機構(gòu))終端銷售額超過10億的產(chǎn)品有8個,在經(jīng)歷了前面的波折后,是否就讓藥企打消了過評的念頭呢?
從目前數(shù)據(jù)來看,除了他克莫司膠囊外,其余7個超10億產(chǎn)品均有企業(yè)正在審評審批中。在第一輪嘗試未果后,部分企業(yè)重新出發(fā)再次申報,目前申報企業(yè)最多的產(chǎn)品是鹽酸氨溴索注射液、注射用帕瑞昔布鈉,各有7家,注射用鹽酸吉西他濱、奧美拉唑腸溶膠囊也各有4家。
過評為何這么難?政策關(guān)逐步打通,技術(shù)關(guān)只能靠企業(yè)
據(jù)CDE的審評結(jié)果,上述32個產(chǎn)品中,不批準通過一致性評價的產(chǎn)品有3個,撤回申請的產(chǎn)品有2個,其余27個已發(fā)批件的產(chǎn)品暫無審評結(jié)果,究竟問題出在哪里呢?我們可以從一些線索中一窺究竟。
海正藥業(yè)于2017年12月28日發(fā)布公告,針對CDE對于他克莫司膠囊給予了“不予通過仿制藥一致性評價申請”評審結(jié)果進行了解釋。海正藥業(yè)表示,公司的他克莫司膠囊屬于國內(nèi)外共線,根據(jù)相關(guān)政策可按國外批準資料申請國內(nèi)一致性評價,但由于該產(chǎn)品于2015年后歐洲原注冊申報國家未予再注冊,無法提供近年來原上市國家臨床使用情況和不良反應(yīng)信息,且該產(chǎn)品在國內(nèi)屬于窄治療指數(shù)藥物,我國對此類藥物的BE試驗有相關(guān)技術(shù)要求,國外BE試驗資料顯示Cmax的90%置信區(qū)間為105.563%-117.928%,未落在我國關(guān)于窄治療窗藥物要求的90.00%-111.11%范圍內(nèi)。據(jù)悉,該公司已重新安排相關(guān)研發(fā)工作,并力爭盡早重新申請一致性評價,但事隔一年多,目前仍未在CDE查詢到該產(chǎn)品最新的申報信息。
白云山于2019年2月2日發(fā)布公告稱,分公司白云山制藥總廠申報藥品一致性評價的羧甲司坦片,因提出撤回申請致使終止注冊程序。公告中提到,按照一致性評價審評審批法規(guī)要求,經(jīng)研究,白云山制藥總廠認為該項目BE研究的批量較小且產(chǎn)品儲存條件與參比制劑有差異,故主動申請撤回。白云山制藥總廠擬根據(jù)國家藥監(jiān)局關(guān)于藥品審評審批的政策和相關(guān)技術(shù)要求,安排相關(guān)研發(fā)工作,擬補充完善后重新提交一致性評價申請,目前暫未在CDE查詢到該產(chǎn)品最新的申報信息。
上述兩個產(chǎn)品未能過評,可以歸結(jié)于“技術(shù)未過關(guān)”,企業(yè)若自查出問題后能主動撤回,也是負責(zé)任的表現(xiàn)。除此之外,還有其他原因嗎?
截至目前,過評的注射劑產(chǎn)品并不多,僅有10個,其中按“通過質(zhì)量和療效一致性評價的藥品”收錄進上市藥品目錄集的只有普利制藥的注射用阿奇霉素,該產(chǎn)品是同步申報中國和美國注冊的雙報品種,擁有國內(nèi)外共線的優(yōu)勢,業(yè)界目前一直認為注射劑一致性評價難度相當(dāng)大。上述27個暫無審評結(jié)果的產(chǎn)品中有12個為注射劑,是不是因為這個原因呢?
一致性評價工作開展之初,主要方向是對準口服制劑,關(guān)于注射劑一致性評價的工作是“不規(guī)定但鼓勵”,因此在早期企業(yè)或許因為無參比制劑、無政策指引等原因造成結(jié)果未如理想也是有可能的。
今年3月28日,化學(xué)藥仿制藥參比制劑第二十一批目錄對外公布,被業(yè)界認為是注射劑一致性評價的啟動信號;隨后第二十二批目錄也有注射劑的影子,被看作是審評提速的標志……近日,有小道消息稱,審評審批相關(guān)部門計劃舉辦注射劑一致性評價核心技術(shù)與實戰(zhàn)經(jīng)驗交流培訓(xùn)班……如此看來,注射劑一致性評價工作已經(jīng)提上了日程,在接下來一段時間極有可能迎來好消息,是前一波未過評產(chǎn)品的“谷底反彈”,還是在審的注射劑陸續(xù)“官宣”?未來可期,靜待時間給予驗證。
文章來源: 米內(nèi)網(wǎng)
編排:季橙 秀太

高同
版權(quán)所有 未經(jīng)許可不得轉(zhuǎn)載
增值電信業(yè)務(wù)經(jīng)營許可證備案號:遼ICP備14006349號
網(wǎng)站介紹 商務(wù)合作 免責(zé)聲明 - html - txt - xml