
科技改變生活 · 科技引領未來

科技改變生活 · 科技引領未來
(健康時報記者王永文)據米內網數據顯示,近10年來,有近60款國產1類新藥獲批上市,其中有鹽酸安羅替尼膠囊、卡瑞麗珠單抗、鹽酸埃克替尼等11款藥物在2020年中國公立醫療機構及中國城市實體藥店終端合計銷售額超過10億元。10家藥企獲批新藥達
(健康時報記者 王永文)據米內網數據顯示,近10年來,有近60款國產1類新藥獲批上市,其中有鹽酸安羅替尼膠囊、卡瑞麗珠單抗、鹽酸埃克替尼等11款藥物在2020年中國公立醫療機構及中國城市實體藥店終端合計銷售額超過10億元。
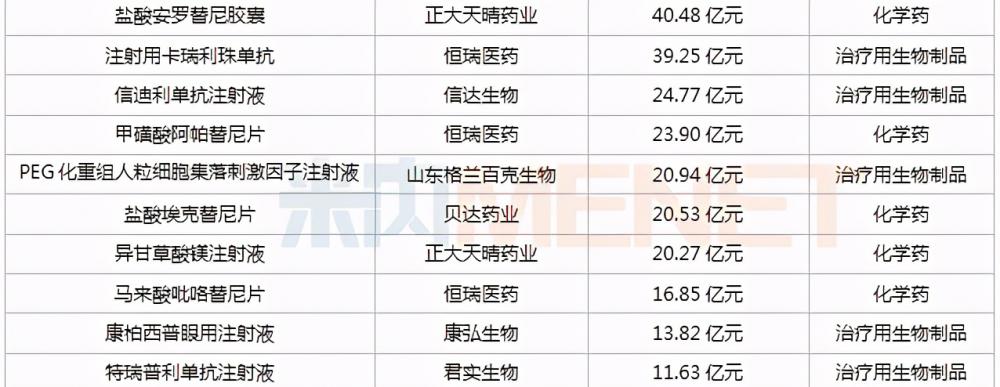
10家藥企獲批新藥達2個及以上,鹽酸安羅替尼膠囊銷售超40億
其中在60個產品中,包括恒瑞醫藥、百濟神州、貝達藥業等10家企業獲批新藥品種數達2個及以上,恒瑞更是以6個品種領跑行業,豪森與百濟神州分別以4個和3個品種緊接其后。在過10億元的產品中,恒瑞占了3個,正大天晴占2個,其中鹽酸安羅替尼膠囊以40.48億元的銷售額領跑超10億元品種榜首。
據正大天晴母公司中國生物制藥在今年2月發布公告,其自主研發的抗腫瘤藥“鹽酸安羅替尼膠囊已獲中國國家藥品監督管理局頒發藥品注冊證書,批準用于治療甲狀腺髓樣癌。這是繼晚期非小細胞肺癌、軟組織肉瘤、小細胞肺癌后,安羅替尼獲批的第四個適應癥。其中新適應癥的獲批意味著安羅替尼成為國內首個可用于治療甲狀腺髓樣癌的靶向藥。
在業內人看來,安羅替尼較多的適應癥和納入醫保是推動銷售額增長的主要原因。安羅替尼于2018年5月獲批,當年10月份以醫保談判的形式被納入醫保目錄,同時,后續陸續有3個適應癥獲批。
批準國產新藥臨床 879 件,仿制藥臨床僅占41件
近幾年來,無論從醫保談判,還是持續推進的帶量采購,政策層面的對創新藥的紅利在逐漸釋放。從審批層面來看,仿制藥的臨床批準逐漸在收緊。據今年4月國家藥品監督管理局發布的《藥品監督管理統計年度報告(2020年)》顯示,2020年國家局共批準新藥臨床 879 件(不包含進口藥品),其中中藥天然藥物 9 件,化學藥品 647 件,生物制品 223 件,批準仿制藥臨床僅 41 件。
同時,創新藥品從上市到納入醫保的時間也大幅縮短。2020年談判準入的藥品,從上市到進醫保的時長,中位數為1.8年。個別藥品甚至當年7月上市,12月就納入醫保,準入周期僅5個月。
“展望未來,中國創新藥的發展將從“有沒有”升級為“好不好”;從國內市場走向國際市場。品種上商業化、差異化、國際化將成為關鍵詞。”據興業證券今年5月發布的一份研報顯示,政策端將藥物經濟學應用于創新藥定價,將會兼顧產品價值、患者獲益、醫保支出等多個核心因素,最終談判價格具備其合理性,“性價比”高的產品將勝出。同時,醫保創新藥談判還兼具市場競爭作用,對一些同類藥品通過競爭性談判,選取質優、最低的價格品種。在節省醫保開支及患者自付費用的大格調下,創新將變得越來越重要。

李龍東
