
科技改變生活 · 科技引領(lǐng)未來(lái)

科技改變生活 · 科技引領(lǐng)未來(lái)
《科創(chuàng)板日?qǐng)?bào)》(上海,記者徐紅)訊,“一次性納入7款罕見(jiàn)病用藥”;“原價(jià)70萬(wàn)一針的天價(jià)罕見(jiàn)病用藥一舉降至3萬(wàn)3”;剛剛過(guò)去不久的藥圈年度盛事—2021年國(guó)家醫(yī)保目錄談判(也稱“國(guó)談”)再次帶火了罕見(jiàn)病用藥。而與之形成鮮明對(duì)比的是,一周之后
《科創(chuàng)板日?qǐng)?bào)》(上海,記者 徐紅)訊,“一次性納入7款罕見(jiàn)病用藥”;“原價(jià)70萬(wàn)一針的天價(jià)罕見(jiàn)病用藥一舉降至3萬(wàn)3”; 剛剛過(guò)去不久的藥圈年度盛事—2021年國(guó)家醫(yī)保目錄談判(也稱“國(guó)談”)再次帶火了罕見(jiàn)病用藥。
而與之形成鮮明對(duì)比的是,一周之后,當(dāng)罕見(jiàn)病“獨(dú)角獸”北海康成-B(01228.HK)正式登陸港交所,上市首日公司卻大跌了近30%。
市場(chǎng)并沒(méi)有“用腳投票”。因?yàn)樽尯币?jiàn)病患者用得起藥,實(shí)現(xiàn)罕見(jiàn)病藥的患者是一項(xiàng)系統(tǒng)性工程,解決支付難題僅僅只是其中一環(huán)。 而在如何做好罕見(jiàn)病藥這個(gè)問(wèn)題上,包括北海康成在內(nèi)的這個(gè)領(lǐng)域的所有企業(yè),仍待闖出一條切實(shí)可行的路子來(lái)。
一款罕見(jiàn)病新藥以創(chuàng)紀(jì)錄速度實(shí)現(xiàn)可及的啟示
罕見(jiàn)病(Rare Disease),往往是指那些發(fā)病率極低的疾病。根據(jù)世界衛(wèi)生組織(WHO)的定義,罕見(jiàn)病為患病人數(shù)占總?cè)丝诘?.65‰~1‰之間的疾病或病變。目前全球已知罕見(jiàn)病約7000種,約占人類疾病的10%,而在這些種類繁多的罕見(jiàn)病當(dāng)中,有約80%是由基因缺陷所導(dǎo)致。
由于罕見(jiàn)病單一病種患病率低,單一病種藥物市場(chǎng)需求量很小,因此制藥企業(yè)很難有足夠的動(dòng)力去研發(fā)相關(guān)藥物,這就導(dǎo)致現(xiàn)階段針對(duì)罕見(jiàn)病的治療手段和藥物均較為有限。有統(tǒng)計(jì)顯示,在全球已知的約7000種罕見(jiàn)病中,真正有藥可用的疾病大概只占到了5%-10%左右。
因此,罕見(jiàn)病一直是全人類的挑戰(zhàn),而各國(guó)也都為此在積極尋求各自的解決之道。
美國(guó)是全球首個(gè)通過(guò)關(guān)于罕見(jiàn)病用藥法案的國(guó)家,在1983年頒布了《孤兒藥法案》。該法案在經(jīng)濟(jì)上對(duì)罕見(jiàn)病研發(fā)進(jìn)行了激勵(lì),包括對(duì)研發(fā)成本的50%給予稅收抵免、設(shè)置孤兒藥專營(yíng)權(quán)排他性條款等,為此后各國(guó)罕見(jiàn)病治療藥物政策的研究作出指引。
在2017年6月,美國(guó)又發(fā)布了《孤兒藥現(xiàn)代化計(jì)劃》,旨在解決孤兒藥產(chǎn)品項(xiàng)目審批大量積壓的問(wèn)題。該計(jì)劃提出90天內(nèi)對(duì)超過(guò)120天的所有請(qǐng)求進(jìn)行完整審核,并要求之后的所有新孤兒藥認(rèn)定時(shí)長(zhǎng)控制在90天以內(nèi),從而加速孤兒藥的審批上市。
中國(guó)大概是從2018年左右起,開(kāi)始加速完善罕見(jiàn)病領(lǐng)域內(nèi)的藥品研發(fā)與審批等相關(guān)政策。
2018年5月22日,國(guó)家衛(wèi)生健康委員會(huì)、科技部、工業(yè)和信息化部、國(guó)家藥品監(jiān)督管理局、國(guó)家中醫(yī)藥管理局等五部門聯(lián)合發(fā)布了《第一批罕見(jiàn)病目錄》(下稱《目錄》),共收錄121種罕見(jiàn)病。
這是中國(guó)首次官方定義罕見(jiàn)病,也是中國(guó)罕見(jiàn)病管理的一個(gè)里程碑式事件。有了這一份目錄,中國(guó)罕見(jiàn)病診療體系的建設(shè)、罕見(jiàn)病的基礎(chǔ)研究、罕見(jiàn)病用藥的上市、研發(fā)及醫(yī)療保障就有了重要的參考依據(jù)。目前,第二批目錄的制定也正在推進(jìn)中。
藥物注冊(cè)審批方面,國(guó)家藥監(jiān)局在2018年及2019年分兩次共推出了78種境外已上市臨床急需新藥名單,其中包括37種罕見(jiàn)病藥物。列入名單的藥品可通過(guò)提交境外研究資料,直接提出上市申請(qǐng)并納入優(yōu)先審評(píng)程序。
對(duì)于絕大多數(shù)人來(lái)說(shuō),這些政策出臺(tái)的意義可能陌生又遙遠(yuǎn),但對(duì)于罕見(jiàn)病患者來(lái)說(shuō)感受卻可能截然不同。
在今年10月舉辦的“浦江醫(yī)藥健康產(chǎn)融創(chuàng)新發(fā)展峰會(huì)”上,中國(guó)罕見(jiàn)病聯(lián)盟執(zhí)行理事長(zhǎng)、中國(guó)醫(yī)院協(xié)會(huì)副會(huì)長(zhǎng)李林康便提及了這樣一個(gè)案例:
氘丁苯那嗪(商品名:安泰坦),這是一個(gè)治療亨廷頓舞蹈癥(Huntington's Disease, HD)的藥物,由以色列梯瓦制藥公司(Teva)所研發(fā)。
氘丁苯那嗪于2017年4月獲美國(guó)FDA批準(zhǔn)上市,是近幾十年來(lái)繼丁苯那嗪之后,F(xiàn)DA批準(zhǔn)的第2個(gè)用來(lái)治療與HD有關(guān)的舞蹈病的新藥。氘丁苯那嗪是丁苯那嗪的氘取代產(chǎn)物,也可以看作是后者的改良新藥。
此前,由于丁苯那嗪一直未在國(guó)內(nèi)上市,國(guó)內(nèi)HD患者長(zhǎng)期以來(lái)一直都面臨無(wú)藥可用的困境。因此在后來(lái),有患者及公益組織就嘗試聯(lián)系了生產(chǎn)企業(yè),希望企業(yè)能夠?qū)⑦@款藥物引入中國(guó)。但考慮到病人數(shù)量有限,加上上市注冊(cè)審批等各方面的成本較高,企業(yè)選擇了放棄。
相較之下,氘丁苯那嗪就幸運(yùn)得多。在美國(guó)獲批之后,隨即在2018年11月入選國(guó)家藥監(jiān)局《第一批臨床急需境外新藥名單》。這意味著,這款藥物如果要在中國(guó)上市的話,可以享受到優(yōu)先審評(píng)的便利,能夠大大降低藥品上市的時(shí)間成本。
2019年12月27日,梯瓦氘丁苯那嗪片正式在中國(guó)遞交新藥上市申請(qǐng)(NDA),并火速在次年5月獲批,成為中國(guó)首個(gè)治療HD的藥物。
從公開(kāi)信息看,以當(dāng)時(shí)氘丁苯那嗪片在美國(guó)的價(jià)格換算,一盒藥的價(jià)格在3萬(wàn)多元人民幣左右,但一盒藥只能吃100天,因此患者每個(gè)月的用藥費(fèi)用高達(dá)萬(wàn)元,這讓很多家庭都無(wú)力承擔(dān)。
因此,闖過(guò)“上市關(guān)”之后,能否被盡快納入醫(yī)保,同樣會(huì)在很大程度上決定這款救命藥是否可以惠及更多病人。
也就是在氘丁苯那嗪獲批的這一年(2020年),繼將國(guó)家醫(yī)保目錄調(diào)整的頻率由此前的數(shù)年一次增至每年一次以后,國(guó)家醫(yī)保局又對(duì)醫(yī)保目錄調(diào)整方案作出了另一項(xiàng)重大改變。
在以往醫(yī)保目錄的調(diào)整中,創(chuàng)新藥的準(zhǔn)入門檻一般是截至上一年的年末,因此談判當(dāng)年新批準(zhǔn)上市的藥物只能等到下一次醫(yī)保目錄調(diào)整。而這一年,醫(yī)保局首次把這個(gè)時(shí)間準(zhǔn)入門檻擴(kuò)大至方案公布之日(8月17日)。
“(這樣做)主要是希望對(duì)于那些剛剛獲批的創(chuàng)新藥,特別是擁有自主知識(shí)產(chǎn)權(quán)的創(chuàng)新藥,給予更快的醫(yī)保目錄準(zhǔn)入機(jī)會(huì),同時(shí)也讓參保人能夠盡早用上有更好臨床價(jià)值的創(chuàng)新藥,盡快從目錄調(diào)整中受益。”國(guó)家醫(yī)保局醫(yī)藥服務(wù)管理司相關(guān)負(fù)責(zé)人在接受媒體采訪時(shí)表示。
也因此,在2020年5月(早于8月17日的準(zhǔn)入門檻)獲批的氘丁苯那嗪獲得了參加當(dāng)年醫(yī)保談判的入場(chǎng)券,并且因?yàn)閳?bào)價(jià)合適被順利納入。
以往一款新藥從申報(bào)上市到獲批,再到取得醫(yī)保支付資格,通常需要數(shù)年甚至更長(zhǎng)時(shí)間,而氘丁苯那嗪只花了1年左右的時(shí)間,這是史無(wú)前例的速度。
在業(yè)內(nèi)看來(lái),這折射出中國(guó)罕見(jiàn)病領(lǐng)域政策環(huán)境的巨大變化,同時(shí)又是政策制定部門、企業(yè)、患者自身、公益組織以及醫(yī)生等多方共同努力的結(jié)果。
支付難題,就已經(jīng)不存在了嗎?
雖然政策環(huán)境在持續(xù)改善,但在現(xiàn)階段罕見(jiàn)病藥物的開(kāi)發(fā)與可及仍然要面臨種種問(wèn)題,包括疾病診斷困難、因?yàn)榛颊呷藬?shù)少臨床試驗(yàn)推進(jìn)不易等,但其中最受關(guān)注的還是支付矛盾。
據(jù)有關(guān)研究,罕見(jiàn)病藥是目前耗時(shí)最多、需要?jiǎng)趧?dòng)量最大和最為資源密集型的藥品,因此其成本和售價(jià)都相對(duì)高昂,超出了大部分患者的支付能力。在中國(guó),這些患者只能將希望寄托于醫(yī)保之上。
今年的國(guó)家醫(yī)保目錄調(diào)整新增了7個(gè)罕見(jiàn)病用藥,其中還有多個(gè)高值罕見(jiàn)病藥,包括因“天價(jià)”屢上熱搜的渤健的諾西那生鈉注射液、武田的阿加糖酶α注射用濃溶液、輝瑞氯苯唑酸軟膠囊等,實(shí)現(xiàn)了高值罕見(jiàn)病用藥進(jìn)入醫(yī)保“零的突破”。
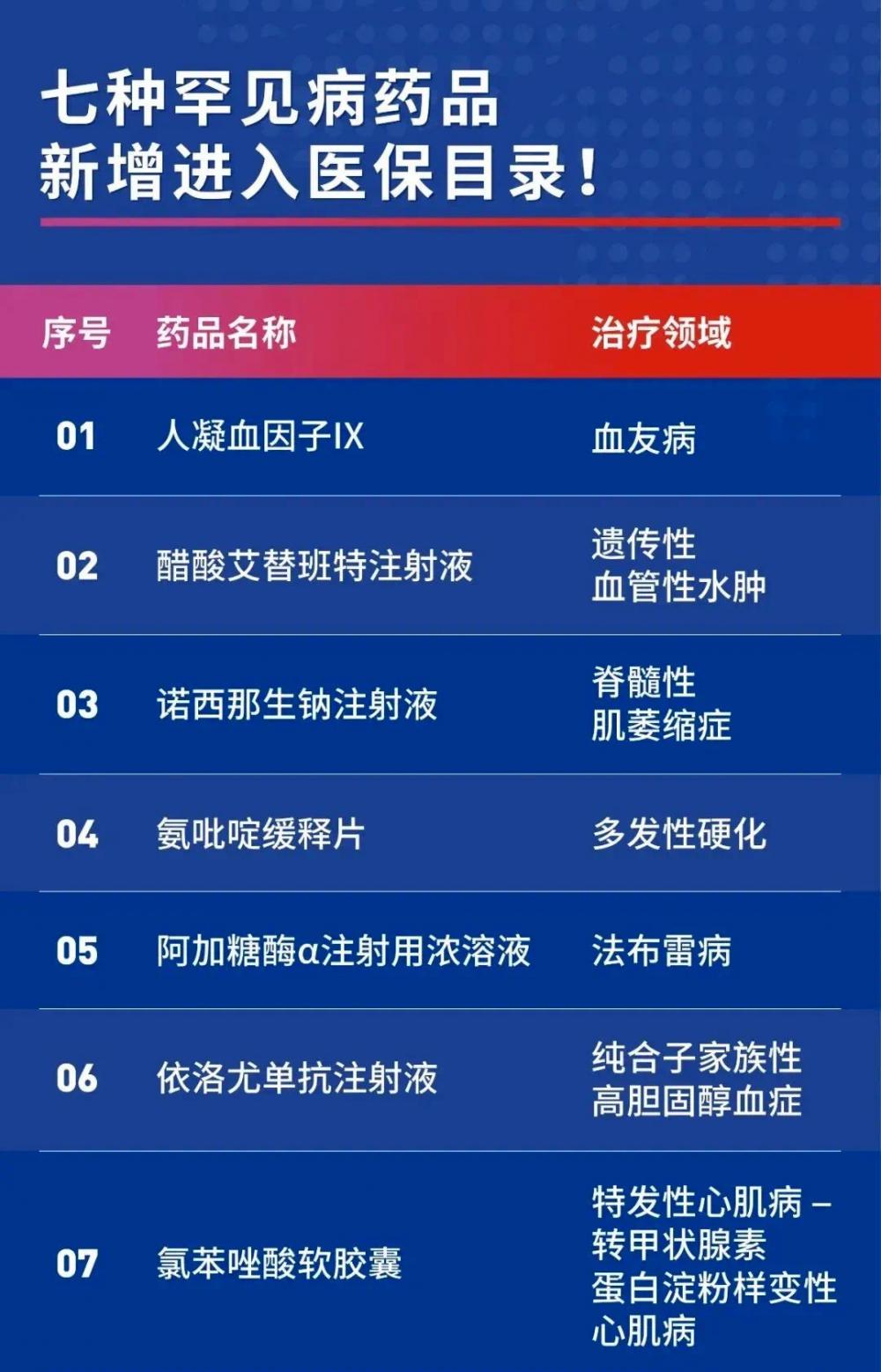
圖|今年被納入醫(yī)保的7個(gè)罕見(jiàn)病藥
“7款罕見(jiàn)病藥物納入醫(yī)保目錄,對(duì)醫(yī)藥企業(yè)針對(duì)罕見(jiàn)病相關(guān)領(lǐng)域的創(chuàng)新研發(fā)將起到正向的激勵(lì)作用,傳遞了利好的信號(hào)。我們相信未來(lái),罕見(jiàn)病領(lǐng)域會(huì)得到更多的關(guān)注,更多患者的治療需求將被發(fā)掘,海外上市新產(chǎn)品將加速引進(jìn)中國(guó),也會(huì)有更多創(chuàng)新企業(yè)加速相關(guān)領(lǐng)域研發(fā),以幫助更多的罕見(jiàn)病患者獲得應(yīng)有的、規(guī)范的治療。”在談判結(jié)果公布之后,輝瑞方面這樣向《科創(chuàng)板日?qǐng)?bào)》記者表示。
不過(guò),雖然今年罕見(jiàn)病藥醫(yī)保談判斬獲頗豐,但需要指出的是,國(guó)家醫(yī)保對(duì)罕見(jiàn)病藥物的覆蓋并不是從今年才開(kāi)始。在2019年、2020年的醫(yī)保目錄調(diào)整中,已分別有9個(gè)和7個(gè)罕見(jiàn)病藥物被納入醫(yī)保。
另?yè)?jù)罕見(jiàn)病公益組織—北京病痛挑戰(zhàn)公益基金會(huì)統(tǒng)計(jì),截至目前,基于國(guó)家《第一批罕見(jiàn)病目錄》,在我國(guó)明確注冊(cè)的罕見(jiàn)病適應(yīng)癥藥品有87種,涉及46種罕見(jiàn)病;截至2021年國(guó)家醫(yī)保談判之后,有28種罕見(jiàn)病的58種藥物已納入國(guó)家醫(yī)保目錄中。
據(jù)此推算,國(guó)家醫(yī)保對(duì)《第一批罕見(jiàn)病目錄》所涉及罕見(jiàn)病藥物的覆蓋已經(jīng)超過(guò)60%。
與此同時(shí),我們也需要看到,一款天價(jià)藥最終能以平價(jià)藥的身份列入醫(yī)保,并不等同于醫(yī)保已對(duì)高值用藥“開(kāi)閘”。
醫(yī)保作為基本醫(yī)療保險(xiǎn),具有普遍性、廣覆蓋、保基本的特點(diǎn),這就決定了進(jìn)入國(guó)家醫(yī)保目錄的藥品首先需要滿足的一個(gè)條件就是“價(jià)格合理”。
“在調(diào)整中,國(guó)家醫(yī)保局牢牢把握‘保基本’的功能定位,將基金可承受作為必須堅(jiān)守的‘底線’,防止天價(jià)藥、昂貴藥進(jìn)醫(yī)保。”國(guó)家醫(yī)保局醫(yī)藥服務(wù)管理司司長(zhǎng)黃華波曾明確表示。
“按照限定的支付范圍,目前國(guó)家醫(yī)保目錄內(nèi)所有藥品年治療費(fèi)用均未超過(guò)30萬(wàn)元。”醫(yī)保談判結(jié)束后,在12月初的新聞發(fā)布會(huì)上,國(guó)家醫(yī)保談判藥品基金測(cè)算專家組組長(zhǎng)鄭杰則透露了這樣一條醫(yī)保藥物的“價(jià)格基準(zhǔn)線”。
雖然降價(jià)對(duì)于企業(yè)來(lái)說(shuō),可能在任何時(shí)候都不會(huì)是一個(gè)容易的決定。但在今年,渤健還是以黑馬之姿,一舉將諾西那生鈉注射液打至地板價(jià),以換取進(jìn)入醫(yī)保的機(jī)會(huì)。
諾西那生鈉注射液在國(guó)內(nèi)獲批上市之初每單位定價(jià)高達(dá)70萬(wàn)元,一年治療費(fèi)用高達(dá)數(shù)百萬(wàn)元。在今年的醫(yī)保談判中,其最初報(bào)價(jià)是53680元(5ml:12mg/瓶 ),后經(jīng)過(guò)數(shù)次調(diào)整,最終降到33000元。
按照諾西那生鈉首年注射6次,降價(jià)后患者首年治療費(fèi)用將降至20萬(wàn)元左右。再以70%-80%的報(bào)銷額度計(jì)算,則患者只需自付4萬(wàn)-6萬(wàn)元左右。此后,患者每年只需注射3次,則每年的治療費(fèi)用進(jìn)一步減至10萬(wàn)元左右(醫(yī)保報(bào)銷前)。
對(duì)此,有業(yè)內(nèi)人士認(rèn)為,諾西那生鈉談判成功的關(guān)鍵還是,當(dāng)醫(yī)保伸出橄欖枝的時(shí)候,“企業(yè)及時(shí)握住了”,雙方均是誠(chéng)意滿滿。
“對(duì)醫(yī)保來(lái)說(shuō),有支持符合條件的罕見(jiàn)病藥品按規(guī)定納入醫(yī)保支付范圍的誠(chéng)意;對(duì)渤健來(lái)說(shuō),公司同樣有給患者提供可及和可持續(xù)治療的誠(chéng)意,所以選擇將價(jià)格降到位。”對(duì)方這樣向《科創(chuàng)板日?qǐng)?bào)》記者表示。
而促使渤健在價(jià)格上作出大幅讓步的一個(gè)重要原因就是來(lái)自羅氏的競(jìng)爭(zhēng)。
公開(kāi)信息顯示,羅氏利司撲蘭口服溶液已經(jīng)在今年6月16日進(jìn)入中國(guó)市場(chǎng),這是全球首個(gè)治療脊髓性肌肉萎縮癥(SMA)的口服藥物。
“渤健諾西那生鈉需要鞘內(nèi)注射給藥,也就是說(shuō)要進(jìn)行腰椎穿刺,這對(duì)于病人來(lái)說(shuō)是比較痛苦的;相較之下,羅氏利司撲蘭是口服藥物,患者依從性更佳。價(jià)格方面,目前利司撲蘭在中國(guó)的定價(jià)是60mg/瓶零售價(jià)6.38萬(wàn)元,加上贈(zèng)藥,年費(fèi)用65萬(wàn)元,與醫(yī)保談判前諾西那生鈉的治療費(fèi)用相當(dāng)。諾西那生鈉在價(jià)格上沒(méi)有明顯優(yōu)勢(shì),依從性又不如利司撲蘭,競(jìng)爭(zhēng)壓力會(huì)比較大,因此降價(jià)在所難免。”據(jù)前述業(yè)內(nèi)人士表示。
中國(guó)的罕見(jiàn)病藥,到底該怎么做?
與大多數(shù)人理解的不一樣,罕見(jiàn)病藥除了那些高值的天價(jià)藥以外,其實(shí)還有很多平價(jià)藥以及一些低價(jià)的“保供藥”。
而連接天價(jià)和平價(jià)的可以說(shuō)是“情懷”。
一般而言,天價(jià)藥需要解決的是部分罕見(jiàn)病患者“無(wú)藥可醫(yī)”的需求,但藥物的研發(fā)及商業(yè)化之難注定這會(huì)是一條布滿荊棘的道路,企業(yè)明知山有虎還向虎山行,很多時(shí)候靠的可能就是一份情懷;
“保供藥”雖樸實(shí)無(wú)華,解決的往往是罕見(jiàn)病患者的基本用藥需求,但因?yàn)閮r(jià)格低廉,甚至有可能還無(wú)法覆蓋企業(yè)成本,因此“保供”也就成了一種情懷。
以上藥生產(chǎn)的“保供藥”青霉胺片為例,100片的價(jià)格是79元,算下來(lái)一片只要0.79元,患者一年的藥費(fèi)在2300元左右,并且青霉胺片還屬于甲類醫(yī)保,也就是說(shuō)患者可100%進(jìn)行醫(yī)保報(bào)銷。青霉胺片是治療肝豆?fàn)詈俗冃缘囊痪€用藥,預(yù)計(jì)每年至少可以惠及5000名患者。
不過(guò),據(jù)《科創(chuàng)板日?qǐng)?bào)》記者了解,由于目前青霉胺片更多時(shí)候是以低于生產(chǎn)成本的售價(jià)在銷售,加上病患人數(shù)有限,這款藥品一年僅能給企業(yè)帶來(lái)1000多萬(wàn)的銷售額。這樣的產(chǎn)品雖然能解病人之急,但還遠(yuǎn)遠(yuǎn)不足以回哺企業(yè)。
情懷很可貴,但顯而易見(jiàn)在當(dāng)前的市場(chǎng)環(huán)境下,只有情懷的中國(guó)罕見(jiàn)病藥物發(fā)展之路不僅會(huì)越走越難,也不可持續(xù),而這正是擺在“北海康成”、“上藥”們眼前的問(wèn)題。
作為較早扎根罕見(jiàn)病新藥研發(fā)的本土明星企業(yè),北海康成有很多讓人稱道的地方,包括擁有快速引進(jìn)外部項(xiàng)目的能力、得到了藥明康德和啟明創(chuàng)投等一眾知名投資人的認(rèn)可、還建立了一支涵蓋10多個(gè)產(chǎn)品的豐富產(chǎn)品管線等。
但即便如此,公司港股上市后的股價(jià)仍是一路下跌。
“北海康成已上市產(chǎn)品賣得并不好。”對(duì)此,一位一級(jí)市場(chǎng)的投資人這樣向《科創(chuàng)板日?qǐng)?bào)》記者指出,“由于國(guó)內(nèi)罕見(jiàn)病患者支付能力有限、商保和醫(yī)保的覆蓋度又還不夠高,導(dǎo)致目前罕見(jiàn)病藥物在國(guó)內(nèi)銷售額不佳、產(chǎn)品管線價(jià)值無(wú)法支撐企業(yè)估值。”
“因此,除細(xì)胞與基因治療等創(chuàng)新技術(shù)外,國(guó)內(nèi)一級(jí)市場(chǎng)對(duì)罕見(jiàn)病的投資相對(duì)會(huì)非常謹(jǐn)慎。而細(xì)胞與基因治療能被看好的原因是,這些創(chuàng)新技術(shù)雖然在目前主要聚焦于罕見(jiàn)病領(lǐng)域,但未來(lái)技術(shù)成熟以后,還能夠在大病種上應(yīng)用。”他并表示。
公開(kāi)資料顯示,北海康成三款國(guó)內(nèi)已上市產(chǎn)品康普舒?(Caphosol?)、賀儷安?(Neratinib?,馬來(lái)酸奈拉替尼片)和海芮思?(Hunterase?,艾度硫酸酯酶β注射液),分別于2018年11月、2020年4月及2020年9月獲批上市。
其中,海芮思?是北海康成在國(guó)內(nèi)成功商業(yè)化的第一個(gè)罕見(jiàn)病藥物,主要用于黏多糖貯積癥Ⅱ型(MPSⅡ,又稱亨特綜合征)的長(zhǎng)期酶替代治療。據(jù)《科創(chuàng)板日?qǐng)?bào)》記者了解,以這款罕見(jiàn)病藥目前在國(guó)內(nèi)的售價(jià)計(jì)算,其一年的治療費(fèi)用在百萬(wàn)以上。

而從北海康成招股書來(lái)看,這3個(gè)產(chǎn)品的上市雖然對(duì)公司收入增長(zhǎng)有一定的拉動(dòng)作用,但整體銷售較之其他非罕見(jiàn)病藥物還是“小巫見(jiàn)大巫”。與此同時(shí),由于其余在研產(chǎn)品的推進(jìn)又需要巨大的研發(fā)投入,導(dǎo)致公司業(yè)績(jī)持續(xù)虧損。
北海康成在2019年、2020年的營(yíng)收分別為147萬(wàn)元、1203萬(wàn)元;期內(nèi)虧損分別為2.17億元、8.46億元。2021年上半年公司營(yíng)收1219萬(wàn)元,期內(nèi)虧損3.44億元。
另外,也有觀點(diǎn)認(rèn)為,與其將北海康成定義為罕見(jiàn)病藥物的研發(fā)企業(yè),不如稱其為罕見(jiàn)病用藥的商業(yè)化公司,因?yàn)樵诒焙?党涩F(xiàn)有的罕見(jiàn)病及罕見(jiàn)腫瘤產(chǎn)品線中,所有8個(gè)產(chǎn)品均來(lái)自授權(quán)引進(jìn)(License-in)。
“授權(quán)引進(jìn)的優(yōu)點(diǎn)是快,但缺點(diǎn)是貴,這樣的話定價(jià)又怎么能下得來(lái)?”另有市場(chǎng)分析人士指出。
高值的創(chuàng)新罕見(jiàn)病藥物,往往是企業(yè)做得起,但患者用不起;而低值的保供藥,是患者用得起,企業(yè)又“做不起”。因此,做患者用得起、企業(yè)也做得起的罕見(jiàn)病藥,就成了企業(yè)希望突破的另一個(gè)方向。
事實(shí)上,如果以臨床需求作為衡量指標(biāo),高值的天價(jià)罕見(jiàn)病藥就是為了解決病患“無(wú)藥可醫(yī)”的需求。但除此之外,罕見(jiàn)病的治療還存在著已有治療方案落后、高價(jià)藥品亟需更經(jīng)濟(jì)的替代方案等其他需求。這部分需求在過(guò)去并不為人所關(guān)注,但又是實(shí)實(shí)在在的臨床痛點(diǎn)。
“很多罕見(jiàn)病患者需要長(zhǎng)期或終身用藥,因此用藥順應(yīng)性很重要。這個(gè)藥要安全,同時(shí)也要好吃好用,我們認(rèn)為尤其是在兒童罕見(jiàn)病藥物的設(shè)計(jì)和研發(fā)當(dāng)中,這是一個(gè)很重要的考量。”北京科信必成醫(yī)藥科技發(fā)展有限公司(以下簡(jiǎn)稱“科信必成”)創(chuàng)新總監(jiān)蔣鑫談道。
據(jù)《科創(chuàng)板日?qǐng)?bào)》記者了解,在糖原累積癥的治療上,臨床現(xiàn)有主流的治療手段是服用生玉米淀粉或改良玉米淀粉,但這種治療方案存在諸多局限,包括睡前及凌晨3點(diǎn)必須服用,而且必須涼水調(diào)服,即使冬天也需用涼水;服用劑量大,并且淀粉經(jīng)涼水沖服后體積膨脹,兒童服用一次治療量的淀粉非常困難等。
針對(duì)這樣的臨床痛點(diǎn),在北京協(xié)和醫(yī)院兒科醫(yī)生提供的藥物研發(fā)思路基礎(chǔ)上,清華大學(xué)進(jìn)行了制劑的設(shè)計(jì),而科信必成則給予了開(kāi)發(fā)資金支持以及專業(yè)系統(tǒng)性藥物研發(fā)的支撐,并在后期承擔(dān)起工藝改良、專利申請(qǐng)、動(dòng)物模型構(gòu)建、臨床實(shí)驗(yàn)申請(qǐng)等工作。據(jù)悉,目前這一針對(duì)糖原累積癥治療的改良型新藥—葡萄糖緩釋微丸已進(jìn)入臨床審批階段。
在采訪中,《科創(chuàng)板日?qǐng)?bào)》記者也注意到,以臨床需求為導(dǎo)向的罕見(jiàn)病藥物研發(fā)的重要性已經(jīng)被越來(lái)越多涉足這個(gè)領(lǐng)域的企業(yè)所認(rèn)識(shí)到,這其中也包括上海醫(yī)藥(601607.SH)。
上藥在2020年12月底成立了自己罕見(jiàn)病藥平臺(tái),即上藥睿爾公司。而在怎么做罕見(jiàn)病藥這個(gè)問(wèn)題上,上藥睿爾也有著自己的思考。
據(jù)了解,圍繞臨床需求與痛點(diǎn),未來(lái)上藥睿爾的罕見(jiàn)病藥物開(kāi)發(fā)將瞄準(zhǔn)多個(gè)方向發(fā)力,包括針對(duì)已有治療方案過(guò)于昂貴或落后等不足而布局的仿制藥、改良型新藥產(chǎn)品,以及針對(duì)臨床急需但治療仍然空白的用藥需求所布局的創(chuàng)新藥等。
“但不管是自研還是授權(quán)引進(jìn),成本是否可控將是我們重點(diǎn)考慮的要素,只有成本可控,價(jià)格才可控。所以,未來(lái)在一些罕見(jiàn)病藥品的研發(fā)中,(我們)會(huì)充分利用上海醫(yī)藥的產(chǎn)業(yè)及轉(zhuǎn)化優(yōu)勢(shì),進(jìn)行全產(chǎn)業(yè)鏈的布局,讓患者有更多的可及性選擇是我們的目標(biāo)。”在日前舉行的2021年中國(guó)罕見(jiàn)病大會(huì)上,上藥睿爾提出。

劉悅遠(yuǎn)
版權(quán)所有 未經(jīng)許可不得轉(zhuǎn)載
增值電信業(yè)務(wù)經(jīng)營(yíng)許可證備案號(hào):遼ICP備14006349號(hào)
網(wǎng)站介紹 商務(wù)合作 免責(zé)聲明 - html - txt - xml